Los datos de la vacuna de Pfizer con los que te tienes que quedar
Eficacia, efectos secundarios... Si sólo vas a leer una cosa sobre la vacuna, que sea esta.
Literalmente hasta ayer no hubo datos en profundidad sobre la vacuna de Pfizer frente al coronavirus, la primera en ser utilizada a gran escala en Occidente. Los expertos se quejaban de que la compañía farmacéutica sólo había publicado notas de prensa, no estudios científicos, pero este martes, 8 de diciembre, la población supo algo más.
La Administración de Medicamentos y Alimentos estadounidense (FDA), la agencia encargada de autorizar la comercialización de medicamentos y vacunas en Estados Unidos, reveló sendos documentos que analizan la vacuna desarrollada por Pfizer y Biontech, precisamente el día que comenzó el programa de vacunación en el Reino Unido.
En estas 145 páginas se desvelan varias de las incógnitas que había sobre la eficacia de la vacuna y se estudian los efectos adversos provocados por la misma. Este jueves la FDA se reúne con expertos independientes para autorizar la comercialización de la inyección.
Entre los documentos publicados hay buenas noticias (sobre todo en cuanto a la eficacia de la vacuna) y alguna duda. Estas son las principales conclusiones:
Ya se había anunciado una eficacia media del 95%. Ahora se ha conocido de dónde salen esos datos. Entre las 40.000 personas que participaron en el ensayo clínico, la mitad recibió la vacuna (en dos dosis) y la otra mitad un placebo. En ese grupo placebo, se registraron 162 casos de coronavirus frente a los 8 que se detectaron entre el grupo que recibió la vacuna. Esto significa que una persona tiene un 95% menos de riesgo de desarrollar la enfermedad cuando está vacunada.
Además, esa eficacia se da en la mayoría de los grupos analizados, incluidas personas de edad avanzada o con comorbilidades, que son los grupos prioritarios para recibir la vacuna.
Y hay otra noticia buena: parece que la vacuna empieza a ser eficaz antes de lo previsto, 14 días después de recibir la primera dosis.
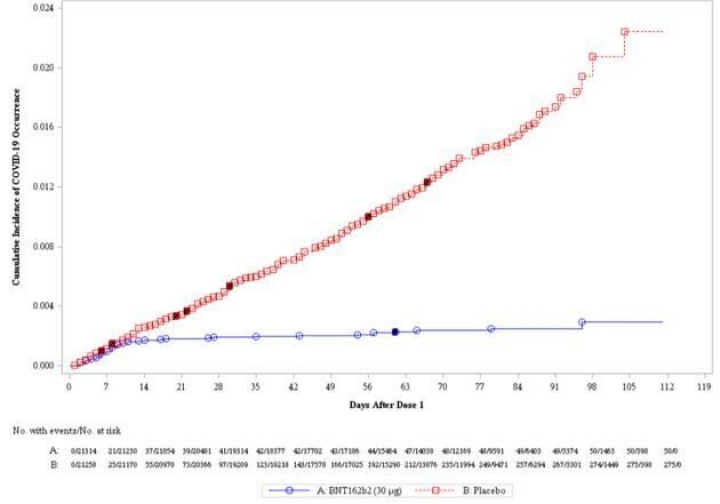
No obstante, eso no quiere decir que con una dosis sea suficiente, ya que los datos no son del todo claros al respecto. Quedan varias incógnitas: por un lado, el análisis termina en noviembre, cuando Pfizer publicó su comunicado. Por otro lado, no se sabe durante cuánto tiempo la vacuna es eficaz.
Y, sobre todo, cabe recordar que este ensayo no permite saber si la vacuna impide coger el coronavirus y transmitirlo. El documento precisa que se consideró como caso confirmado cuando un participante del ensayo desarrolló síntomas parecidos a los del coronavirus y entonces se sometió a una prueba PCR. Por lo tanto, quedan fuera de esa lista las personas que pudieron contagiarse pero no desarrollaron síntomas.
En definitiva, aparentemente la vacuna protege frente a la enfermedad, pero por el momento no hay forma de saber si bloquea realmente la transmisión.
Antes de autorizar una vacuna, las agencias evalúan la seguridad del medicamento; es decir si presenta riesgos para la población.
En sus ensayos clínicos, Pfizer y Biontech han seguido con atención el estado de salud de los participantes, y han descubierto que la vacuna tiene algunos efectos secundarios (como la gran mayoría de vacunas) que, en general, resultan bastante frecuentes. El 84% de los pacientes del grupo vacuna refirieron sentir dolor en la zona en la que le pusieron la inyección; el 62% sintió fatiga, el 55%, dolor de cabeza, el 31% dijo sentir temblores y un 14% tuvo fiebre.
Estos efectos fueron severos para el 5% de los participantes, y fueron menos frecuentes en las personas de más de 55 años (una buena noticia, ya que son parte de los grupos prioritarios de vacunación).
Según los datos de Pfizer, sólo el 0,5% de los participantes tuvo efectos secundarios serios. Además, ocurrieron en el grupo vacuna y en el grupo placebo en una proporción similar, con lo cual con este ensayo es imposible deducir que la vacuna pueda causar efectos adversos graves.
No obstante, hay un pero. Si la vacuna produjera un efecto grave en una de cada 100.000 personas, no podría saberse, ya que en los ensayos clínicos ‘sólo’ participaron 40.000 personas. Por eso cuando empiecen las campañas de vacunación en los diferentes países habrá que seguir comprobando si se produce algún tipo de efecto secundario raro.
Y hay otro detalle más que se desprende de los documentos de Pfizer/Biontech y que preocupa en cierta medida. Entre el grupo de participantes que recibió la vacuna, se registraron cuatro casos de parálisis de Bell, una forma de parálisis facial que, sin embargo, no se detectó en el grupo placebo. No obstante, según precisa el documento desvelado por la FDA, esos cuatro casos “no representan una frecuencia superior a la que está prevista en la población general”.
En el mundo se producen cada año entre 15 y 30 casos de parálisis de Bell por cada 100.000 habitantes. En el grupo que fue vacunado se registraron 21 casos por 100.000 personas (4 pacientes de 18.801). Aunque cuatro de cada cinco personas afectadas por esta enfermedad se curan por completo, los especialistas inciden en que habrá que vigilar de cerca la relación entre esta afección y la vacuna.
Este artículo ha sido adaptado de la edición francesa del HuffPost.