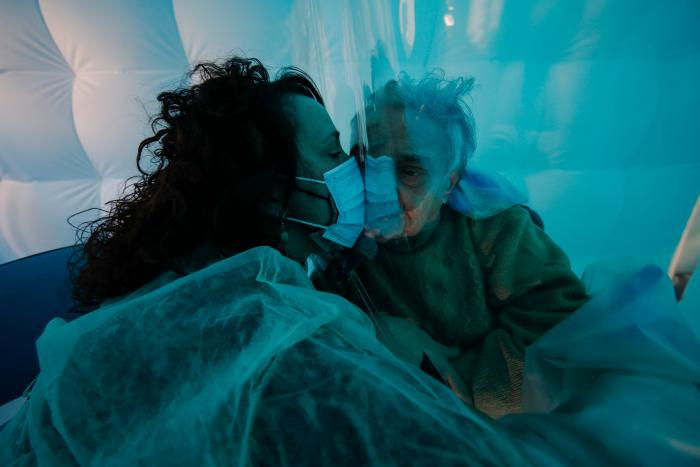
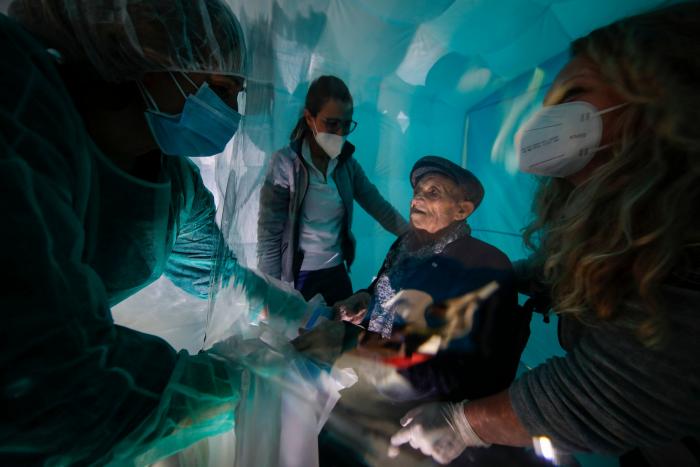
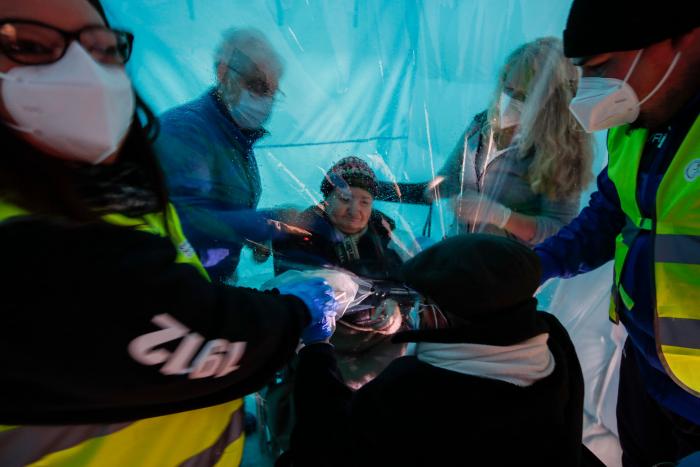
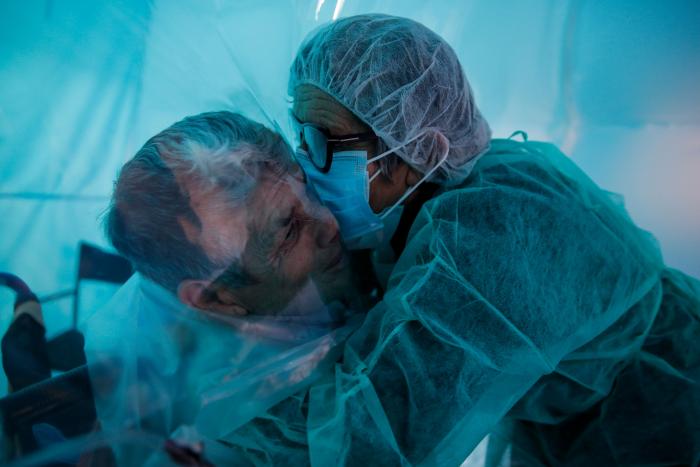
La Agencia Española del Medicamento autoriza el ensayo clínico en fase dos de la vacuna española contra la covid
Las pruebas del fármaco de Hipra se desarrollarán en 10 centros hospitalarios con más de mil voluntarios y una ayuda de 15 millones de euros.
Buenas noticias para el desarrollo de una de las vacunas españolas contra el coronavirus. El presidente del Gobierno, Pedro Sánchez, ha anunciado que el proyecto de la empresa Hipra ha dado un importante y vital salto. La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha autorizado este lunes el ensayo clínico en fase II de la vacuna contra la COVID-19 de esta firma.
Esta segunda fase contará con una ayuda de 15 millones de euros y se realizará en 10 centros hospitalarios con más de un millar de voluntarios, tal y como ha indicado el presidente, durante la presentación de los Proyectos Estratégicos para la Recuperación y Transformación Económica (PERTE) en la sede del Instituto Carlos III de Madrid.
“Es una extraordinaria noticia para la ciencia y la sociedad española y que demuestra que España se puede situar a la vanguardia de la lucha contra el covid”, ha destacado Pedro Sánchez, quien ha defendido la importancia de la apuesta por la colaboración público-privada. “Es un motivo más para sentir orgullo de país”, ha celebrado.
Con la vista puesta en la comercialización en 2022
La ministra de Ciencia, Diana Morant, ya había puesto fecha al horizonte para la comercialización de la vacuna de la compañía catalana. A mediados del pasado mes de agosto, cuando se inició la primera fase de ensayo clínico, Morant había apuntado “a principios de 2022”.