La EMA aprueba el uso de la vacuna de Moderna en Europa
Después de la de Pfizer, esta es la segunda vacuna frente al covid que será administrada en la UE.

Con unos días de antelación, la Agencia Europea del Medicamento (EMA) ha autorizado este miércoles el uso de la vacuna contra el covid de Moderna en la Unión Europea.
La reunión extraordinaria, que estaba fijada primero para el 12 de enero, se adelantó al lunes 4 y continuó este miércoles 6, día en que finalmente la Agencia ha dado luz verde a la fórmula de la farmacéutica estadounidense Moderna.
“El número de infecciones está aumentando en toda Europa y somos conscientes de la enorme responsabilidad que tenemos de llevar una vacuna al mercado lo más rápido posible, manteniendo la solidez de nuestra revisión científica”, dijo hace unos días la directora ejecutiva de la EMA, Emer Cooke.
El comité, formado por representantes de los 27 países de la UE, ha analizado el paquete de datos puesto a su disposición por la farmacéutica Moderna, a la que ha podido consultar sobre la seguridad, el proceso de producción o la eficacia de la vacuna, hasta determinar que es seguro usarla.
Moderna se suma a Pfizer
Esta es la segunda vacuna en recibir el visto bueno de los científicos de la Unión Europea, después de la aprobación el pasado 21 de diciembre del fármaco desarrollado contra el covid-19 por las compañías Pfizer/BioNTech, que ya se está usando en la UE desde la semana pasada.
En cuanto a su transporte y almacenamiento, el fármaco de Moderna presenta varias ventajas con respecto al de Pfizer. Mientras que la vacuna de Pfizer debe guardarse en ultracongeladores a -70ºC, la de Moderna se almacena a -20ºC, la temperatura de un congelador estándar, y aguanta hasta 30 días si se mantiene entre 2 y 8º C, temperatura que alcanza cualquier frigorífico.
En el caso de la inyección de Pfizer, los países necesitaron seis días para empezar a administrarla desde su aprobación por parte de la EMA, lo cual hace intuir que la vacuna de Moderna podría comenzar a suministrarse muy pronto. “La compañía tiene el compromiso de que en los siguientes 15 días esté disponible”, ha asegurado en una entrevista en la Cadena SER la directora general de Salud Pública española, Pilar Aparicio.
En Estados Unidos la vacuna de Moderna se empezó a administrar el 21 de diciembre, apenas 48 horas después de que fuera aprobada por la Administración de Alimentos y Medicamentos (FDA) estadounidense.
En Europa, el Comité de medicamentos humanos (CHMP) tiene también abiertos desde el 1 de diciembre dos procesos de revisión en tiempo real de la vacuna desarrollada por la farmacéutica Janssen y de la de Oxford/AstraZeneca, que se administra desde este lunes en Reino Unido.
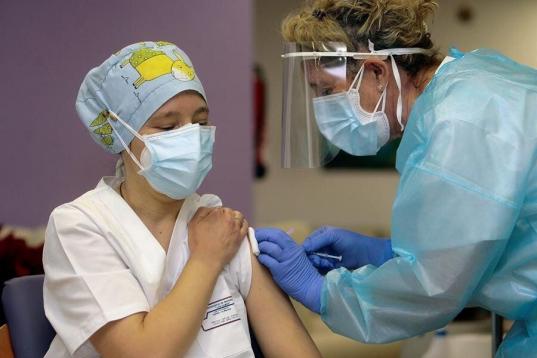
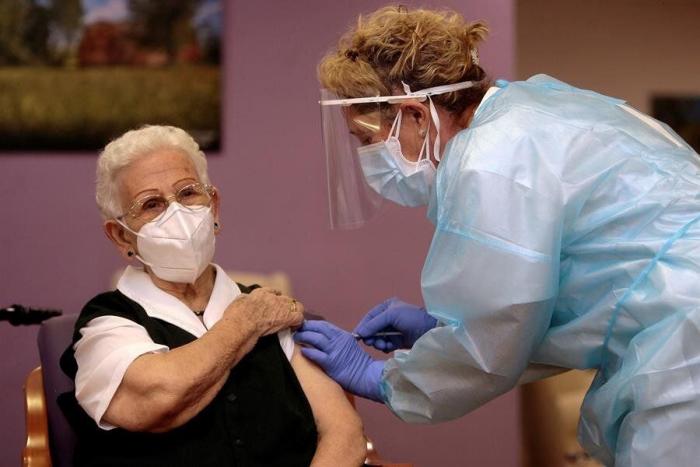
Tanto la vacuna de Pfizer como la de Moderna, cuya tasa de efectividad ronda el 95%, se administrarán de forma indistinta en España, empezando por los grupos prioritarios de ancianos en residencias y personal sanitario de primera línea, como hasta ahora.
Por lo pronto, Bruselas ha reservado un total de 160 millones de dosis de la vacuna de Moderna, de la que se necesitan dos inyecciones por persona con un mes de diferencia entre la primera y la segunda.
La Comisión Europea autoriza su uso
Poco después de conocerse la noticia, la Comisión Europea (CE) ha otorgado una licencia condicional a Moderna para el uso en los países europeos de su vacuna contra el virus en Europa.
“Hemos autorizado la vacuna de Moderna, la segunda vacuna aprobada en la UE”, ha escrito en Twitter la presidenta de la Comisión Europea, Ursula von der Leyen.